من إعداد : ال طالب
Elsayed kamal elsaeed تابع: مراجعةكمال السعيد عبد الرحمن
: تصميمكمال السعيد عبد الرحمن
الرموز الكيميائية للعناصر 1- أقترح العلماء رموزا تعبر عن العناصر ( علل ) لسهوله التعامل معها . 2- هناك بعض العناصر رمزها يتكون من حرفين (علل ) لتشابها في الحرف الاول لهذا العنصر مع الحرف الاول لعنصر اخرمثل الكربون C) ) و الكالسيوم (Ca) 3- اذا كان رمز العنصر يتكون من حرفين يكتب الحرف الاول كبتل و الثانى صمول مثل (Na) تركيب الذرة تعريف الذرة : هي الوحدة البنائية الأساسية للمادة ،التي تشارك في التفاعل الكيميائي تتكون من 1- نواة موجبة الشحنة الكهربية . 2- إلكترونات صغيرة جدا سالبة الشحنة تدور حول النواة . (أولا) النواة : 1- تقع النواة فى مركز الذرة وتتركز فيها كتلة الذرة .( 2- النواة موجبة الشحنة (علل) : لاحتوائها على جسيمات موجبة الشحنة ( + ) تسمى بروتونات ، وجسيمات متعادلة الشحنة ( +_ ) تسمى نيوترونات . 3- عدد النيوترونات في نواة الذرة قد يكون مساويا لعدد البروتونات وقد يزيد عنها . ملحوظة :- عدد النيوترونات = العدد الكتلي – العدد الذرى (ثانيا) الإلكترونات : هى الإلكترونات جسيمات سالبة الشحنة الكهربية ( - ) تدور حول النواة بعض الاسئلة و الملحوظات الهامة 1- (علل)كتلة الذرة مركزة في نواتها ؟ لان الإلكترونات جسيمات متناهية في الصغر كتلتها مهملة إذا ما قورنت بكتلة كل من البروتون أو النيوترون الموجودة في نواة الذرة 2- (علل) الذرة متعادلة كهربيا في حالتها العادية؟ لتساوى عدد الإلكترونات السالبة التي تدور حول النواة مع عدد البروتونات الموجبة الموجودة داخل نواة الذرة . 3- (علل) تدور الإلكترونات ( سالبة الشحنة ) حول النواة ( موجبة دون أن تسقط فى نواة الذرة؟ لأنها تدور بسرعات فائقة حول نواة الذرة . 4- وبذلك يكون العدد الذرى للعنصر مساويا أيضا لعدد الإلكترونات الموجودة فى مدارات ذرة هذا العنصر ( ثالثا ) مستويات الطاقة : - هي مناطق وهمية تتحرك خلالها الإلكترونات حسب طاقتها . خصائص مستويات الطاقة : 1- لا يزيد عدد مستويات الطاقة التى تحتوى على إلكترونات فى أكبر الذرات المعروفة عن سبعة مستويات ملاحظات هامة 1- (علل) لا تنطبق العلاقة 2ن 2 على المستويات الأعلى من المستوى الرابع ؟ وذلك لأن الذرة تصبح غير مستقرة 2- لا يزيد عدد الإلكترونات فى مستوى الطاقة الخارجي لأي ذرة عن 8 إلكترونات ما عدا المستوى k لا يحمل أكثر من 2 إلكترون . 3- إذا إكتسب الإلكترون مقدارا من الطاقة ( تسمى الكم ) فإنه ينتقل من مستوى طاقة أقل إلى مستوى طاقة أعلى وتصبح الذرة مثارة . 4- إذا فقد الإلكترون هذا الكم من الطاقة فإنه يعود إلى مستواه الأصلي مرة أخرى وتعود الذرة إلى حالتها العادية 5- طاقة المستوى = طاقة الالكترون والعكس - الكم ( الكوانتم ) : هي كمية الطاقة التي كتسبها أو يفقدها الإلكترون حتى ينتقل من مستوى طاقة إلى مستوى طاقة آخر . الذرة المثارة :- هى الذرة التى اكتسبت كما من الطاقة )رابعا) التوزيع الإلكتروني : مثال(1) ذرة النيتروجين 7N العدد الذري لها = 7 أي أن عدد البروتونات = عدد الالكترونات = 7 والالكترونات تتوزع على المستويات كالأتي لأن المستوى K يتشبع بـ 2 إلكترون وتتبقى 5 الكترونات تشغل المستوى L مثال (2) ذرة الصوديوم 11Na : العدد الذري لها 11 أي أن عدد الالكترونات =11 وتتوزع كما يلي المستوى K 2الكترون والمستوى L 8الكترونات والمستوى M 1الكترون العلاقة بين التركيب الالكتروني والنشاط الكيميائي عدد الكترونات المستوى الخارجي للذرة والنشاط الكيميائي الذرة اثناء التفاعل الكيميائي
:ملخص للدرس من اعداد Elsayed kamal elsaeed
طرق أخرى لشرح الدرس
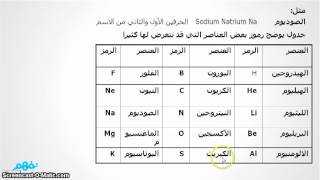
من إعداد:
نورا عاطف
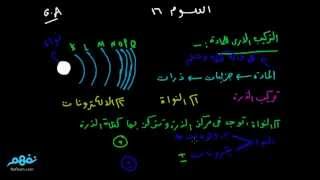
من إعداد:
منى احمد عبد الحليم

من إعداد:
مستر أحمد حمدى

من إعداد:
Nafham School Team

من إعداد:
الاستاذ احمد الحوت

من إعداد:
Nafham Team - Admin
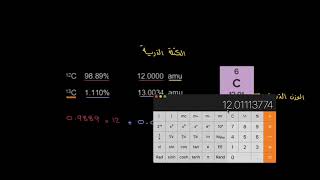
من إعداد:
Nafham Team - Admin

من إعداد:
Nafham Team - Admin

من إعداد:
Nafham School Team

من إعداد:


























التعليقات